Ha valaha is gondolkodtál azon, hogyan képesek a sejtek olyan dinamikusan mozogni, alakot váltani vagy akár agresszíven terjedni a szervezetben, akkor most egy igazán izgalmas kutatási eredményről fogok mesélni. Egy friss tanulmányban kiderült, hogy a glikolízis – azaz a cukorlebontás egyik legfontosabb anyagcsere útja – kulcsenzimei nem csak szétszórtan lebegnek a citoplazmában, hanem koncentráltan gyűlnek össze az úgynevezett aktin hullámokban és sejtkitüremkedésekben. Ez pedig nem csupán egy biokémiai érdekesség, hanem alapjaiban változtathatja meg a rákos sejtek energiafelhasználásáról és mozgásáról alkotott képünket.
Hogyan fedezték fel az enzimek koncentrációját az aktin hullámokban?
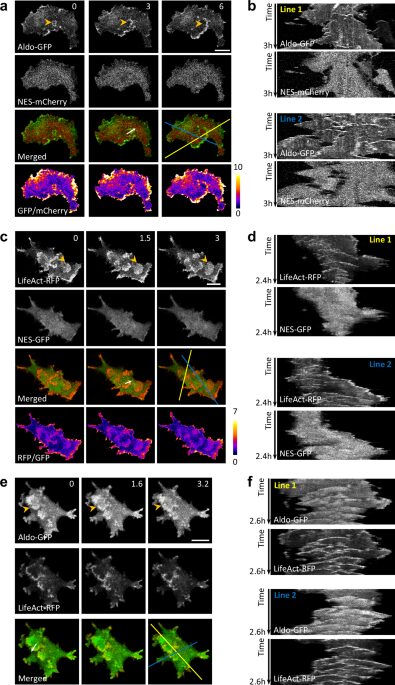
A kutatók először egy MCF-10A M3 emlőhámrák sejtvonalban jelölték meg zöld fluoreszcens fehérjével (GFP) az aldoláz nevű glikolitikus enzimet. A sejteket mikroszkóp alatt vizsgálva meglepő dolgot tapasztaltak: bár az aldoláz nagy része szabadon keringett a citoplazmában, jelentős mennyiségben összegyűlt azokban a dinamikus hullámokban, amelyek végigfutottak a sejt alapi felszínén.
Ezeket az aktin hullámokat korábban is ismerték mint F-actin polimerizációs zónákat, de hogy ennyi glikolitikus enzim is ott koncentrálódik, az engem személy szerint nagyon meglepett. A hullámok mozgását időbeli és térbeli kymográfiákkal is elemezték, amelyek jól mutatták az enzimek dinamikus viselkedését.
Aldoláz és LifeAct – együtt mozogva
A LifeAct egy olyan marker, amely az újonnan képződő elágazó F-actint jelzi. Amikor egyszerre jelölték meg LifeAct-RFP-vel (piros fluoreszcens fehérje) és aldoláz-GFP-vel a sejteket, kiderült, hogy mindkét fehérje gazdagon jelen van ezekben a hullámokban és azokból kinövő kitüremkedésekben. Bár az aldoláz eloszlása valamivel diffúzabb volt, mint a LifeAct-é, térben és időben szorosan követték egymást.
Ez arra utalhat, hogy az aktin hullámok nem csupán szerkezeti elemek, hanem metabolikus központok is lehetnek – mintha egy mini gyárként működnének, ahol helyben termelődik az energia.
További glikolitikus enzimek is bekapcsolódnak
Nem csak az aldoláz volt jelen: öt másik kulcsfontosságú glikolitikus enzim – hexokináz (HK), foszfofruktokináz (PFK), gliceraldehid-3-foszfát-dehidrogenáz (GAPDH), enoláz (ENO) és piruvát-kináz (PK) – szintén gazdagon halmozódott fel ezekben az aktin hullámokban. Ezeket különböző fluoreszcens címkékkel látták el, így egyszerre tudták követni őket LifeAct markerekkel együtt.
A hullámokon belüli eloszlásuk nagyon hasonló volt: mindegyik enzim erősen koncentrálódott az aktin hullámokra és kitüremkedésekre. Ez azt sugallja, hogy a teljes glikolízis útvonal helyi aktiválódása zajlik ezekben a dinamikus struktúrákban.
Az endogén enzimek is ezt mutatják
Nem csak mesterségesen jelölt fehérjéket vizsgáltak: immunfluoreszcens festéssel kimutatták, hogy a természetes állapotban lévő glikolitikus enzimek is pontosan ugyanígy halmozódnak fel ezekben a hullámokban. Ez fontos bizonyíték arra, hogy nem valami laboratóriumi műtermékről van szó.
Milyen hatással vannak ezek a hullámok a sejtek energiatermelésére?
A kutatók továbbmentek: méréseket végeztek egy speciális ATP bioszenzorral (iATP), amely képes valós időben jelezni a sejt energiaszintjét. Kiderült, hogy amikor növelték az aktin hullám aktivitását például EGF (epidermális növekedési faktor) és inzulin hozzáadásával – amelyek ismerten fokozzák a Ras/PI3K jelátvitelt –, akkor jelentősen nőtt az ATP szint is.
Ezzel párhuzamosan nőtt az aldoláz és PFK által jelzett hullámtevékenység is. Ez azt sugallja, hogy ezeknek az enzimeknek a koncentrációja valóban fokozza a glikolízist és ezáltal több energiát termelnek helyileg.
Mi történik ha megszakítjuk ezeket a hullámokat?
Latrunculin A-val blokkolták az aktin polimerizációt, ami drasztikusan csökkentette mind az aktin hullámokat, mind pedig az ATP szintet. Érdekes módon még ha EGF-t és inzulint adtak is utána, nem tudták visszahozni ezt az aktivitást – tehát maga a hullámtevékenység létfontosságú volt az energia termeléshez.
A PI3K jelút szerepe
A PI3K gátlása LY294002 vegyülettel szintén csökkentette mind az aktin hullámokat, mind pedig az ATP termelést. Ez megerősíti azt a modellt, miszerint ez a jelút szabályozza ezeket a dinamikus struktúrákat és ezzel együtt a helyi anyagcserét.
Hogyan befolyásolják ezek a folyamatok a sejtek mozgását?
A kutatók mesterségesen toboroztak PFK-t vagy aldolázt közvetlenül a plazmamembránhoz különböző rendszerekkel (CID vagy optogenetika). Meglepő módon ez önmagában elegendő volt ahhoz, hogy fokozza az aktin hullámokat és kitüremkedéseket, valamint növelje a sejtek mozgékonyságát és polarizációját.
Egyetlen enzim membránhoz való toborzása ilyen drasztikus változásokat idézett elő! Ez arra utalhat, hogy ezeknek az enzimeknek nem csak anyagcsere szerepük van, hanem közvetlenül befolyásolják a citoszkeleton dinamikáját is.
Klinikai jelentőség: mi köze van mindennek a rákhoz?
A ráksejtek jól ismert tulajdonsága, hogy még oxigén jelenlétében is inkább glikolízissel termelik energiájukat – ezt hívjuk Warburg-effektusnak. A tanulmány szerint ez részben annak köszönhető, hogy ezekben a sejtekben jóval több aktin hullám van jelen, amelyekhez rengeteg glikolitikus enzim kapcsolódik.
Egy MCF-10A eredetű sejtsorozaton végzett vizsgálat során látható volt, hogy ahogy nőtt egy adott sejtvonal malignitása és áttétképző képessége (M1-től M4-ig), úgy nőtt párhuzamosan mind az aktin hullám aktivitás, mind pedig az ATP szint glikolízisből származó része.
További ráktípusokon végzett vizsgálatok megerősítették ezt: minél több volt egy adott sejtvonalban ezeket mutató hullámtevékenységből, annál inkább támaszkodtak glikolízisre energiaforrásként.
Milyen hatással van mindez a rákos sejtek életfolyamataira?
A kutatás azt is kimutatta, hogy ha gátolják ezeket a glikolitikus hullámokat vagy magát a glikolízist (például 2-Deoxy-D-glükózzal vagy 3-Bromopiruváttal), akkor jelentősen csökkennek olyan folyamatok mint:
- Makropinocitózis – nagyobb tápanyagfelvétel
- Fehérjeszintézis sebessége
- Sejtmozgás és morfológiai dinamika
Ezzel szemben mitokondriális légzés gátlása alig befolyásolta ezeket folyamatokat ebben a modellben.
Összegzés: egy új paradigma születik
Ezek alapján úgy tűnik, hogy a glikolitikus enzimek koncentrált megjelenése az aktin alapú hullámokban nem véletlen biológiai melléktermék, hanem egy evolúciós trükk arra, hogy hatékonyan összpontosítsa az energia-termelő gépezetet ott ahol éppen szükség van rá – például mozgó vagy terjedő sejtek esetében.
Ez engem személy szerint lenyűgözött: mennyire összetett mégis elegáns módon működik együtt anyagcsere és citoszkeleton!
A felfedezés új távlatokat nyithat nem csak alapkutatásban hanem terápiás fejlesztésekben is: ha sikerül célzottan befolyásolni ezt a rendszer működését, talán hatékonyabban lehet majd kezelni agresszív daganatokat vagy szabályozni sejtmozgást gyulladásos betegségekben.