A gliomák a központi idegrendszer leggyakoribb rosszindulatú daganatai, melyek az egyik legmagasabb halálozási arányt mutatják a felnőttkori agydaganatok között. A WHO osztályozása alapján I-IV. fokozatig terjedő tumorosztályokat különböztetünk meg, ahol a IV. fokozatú glioblastoma multiforme (GBM) a legagresszívebb altípus, melynek medián túlélése mindössze 14 hónap, az 5 éves relatív túlélési arány pedig csupán 7%.
Az LRIG géncsalád bemutatása
Az LRIG (leucin gazdag ismétlődéseket és immunglobulin-szerű doméneket tartalmazó) géncsalád három tagból áll: LRIG1, LRIG2 és LRIG3. Ezek az integráns membránfehérjék hasonló szerkezettel rendelkeznek, mely egy jelző peptidet, 15 leucin gazdag ismétlődést (LRR), három immunglobulin-szerű domént, transzmembrán szegmenst és citoplazmatikus farki részt foglal magába.
Az LRIG fehérjék fontos szerepet töltenek be az onkogén epidermális növekedési faktor receptor (EGFR) szabályozásában, amely genetikai eltérésekkel 57%-ban érintett a GBM-ekben. Az LRIG család tagjai képesek negatívan befolyásolni az EGFR és más receptor tirozin-kinázok aktivitását, így potenciális célpontként szolgálhatnak a gliomák kezelésében.
Az LRIG1-3 fehérjék eltérő szerepei a daganatbiológiában
- LRIG1: Leginkább tanulmányozott tumor-szuppresszor fehérje, amely gátolja az EGFR aktivitását, elősegíti az apoptózist, csökkenti a daganatsejtek proliferációját és invázióját, valamint gátolja a tumor angiogenezisét. Emellett fokozhatja a kemoterápiás szerekre (pl. temozolomid, cisplatin) való érzékenységet és helyreállíthatja a radio-szenzitivitást radio-rezisztens GBM-ekben.
- LRIG2: Ezzel szemben tumor-promóterként ismert, elősegíti a glioma növekedését és magasabb tumorosztályokkal hozható összefüggésbe. Serkenti a proliferációt és angiogenezist, miközben gátolja az apoptózist és inváziót. Egerekben az LRIG2 hiánya csökkenti a PDGFB-indukált gliomák kialakulását.
- LRIG3: Hasonló funkciókat tölt be, mint az LRIG1, tumor-szuppresszor hatású lehet. Gátolja a proliferációt, inváziót és angiogenezist, miközben elősegíti az apoptózist. Alacsonyabb tumorosztályokhoz és jobb túlélési esélyekhez kötött.
Kutatási célkitűzés
A tanulmány célja volt feltárni az LRIG1-3 expressziós mintázatát különböző WHO szerinti glioma stádiumokban, összehasonlítani elsődleges és másodlagos GBM-eket, valamint vizsgálni a kemoterápia hatását ezen fehérjék kifejeződésére.
Módszerek
A kutatás során humán tumor szövetmintákat gyűjtöttek idegsebészeti műtétek során Köln Egyetemi Kórházában (1998–2017). A mintákat WHO 2007-es osztályozása szerint csoportosították: alacsony fokozatú (II), közepes fokozatú (III), elsődleges GBM (primáris), másodlagos GBM (secundáris), továbbá kemoterápiával kezelt és nem kezelt alcsoportokat különítettek el.
A fehérjeexpressziót kvantitatív Western blot analízissel mérték, míg az mRNS szinteket qPCR-rel határozták meg. Immunfluoreszcens festéssel vizsgálták az LRIG fehérjék sejtspecifikus lokalizációját.
Eredmények
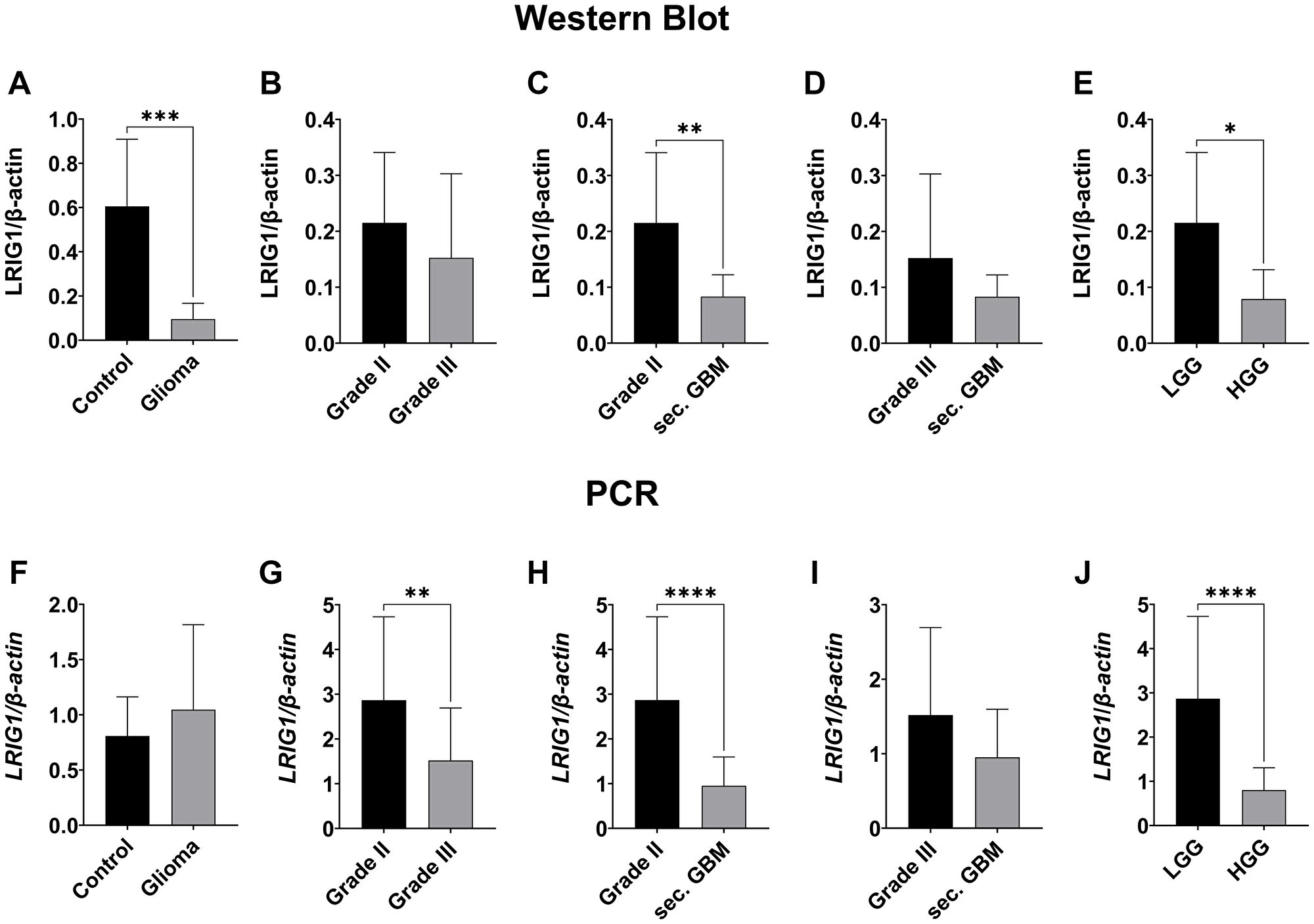
LRIG1 expresszió
Az LRIG1 protein szintje jelentősen alacsonyabb volt gliomás szövetekben a peritumorális kontrollhoz képest (p=0.0004). Az expresszió negatív korrelációt mutatott a WHO tumor fokozattal: alacsony fokozatú gliomákban magasabb volt (p=0.0118) mint magas fokozatúakban. Másodlagos GBM-ekben jelentősen magasabb volt az LRIG1 protein expressziója elsődleges GBM-ekhez viszonyítva (p=0.014). A kemoterápia hatása nem volt szignifikáns, bár tendenciaként elsődleges GBM-ben csökkentette az LRIG1 szintet.
LRIG2 expresszió
Az LRIG2 esetében érdekes módon eltérő tendenciákat figyeltek meg mRNS és protein szinten: míg mRNS-ben alacsonyabb volt magas fokozatú gliomákban (p=0.0009), addig protein szinten enyhe emelkedést mutatott a tumor malignitásával. Másodlagos GBM-ekben jelentősen magasabb volt az LRIG2 protein expressziója elsődleges GBM-ekhez képest (p=0.0003). A kemoterápia tendenciózusan csökkentette az LRIG2 kifejeződését mindkét GBM típusban.
LRIG3 expresszió
Az LRIG3 mRNS szintje jelentősen magasabb volt gliomás szövetekben kontrollhoz képest (p=0.039), különösen II-es fokozatú gliomákban (p=0.0002). Alacsony fokozatú daganatokban magasabb expressziót mutatott mint magas fokozatúakban, bár ez nem volt mindig statisztikailag szignifikáns. Kemoterápia hatására elsődleges GBM-ben nőtt az LRIG3 mRNS expresszió (p=0.0066). Protein szinten immunfluoreszcens festés igazolta az alacsony fokozatú daganatokban erősebb jelölést.
Megbeszélés
Eredményeink megerősítik korábbi feltételezéseket arról, hogy az LRIG1-3 fehérjék fontos szerepet játszanak a gliomák biológiájában, különösen diagnosztikai markerként és potenciális terápiás célpontként szolgálhatnak.
LRIG1, mint tumor-szuppresszor fehérje expressziója csökkent gliomákban és negatívan korrelált a tumor agresszivitásával – ez összhangban áll korábbi irodalmi adatokkal. Az LRIG3-hoz hasonlóan főként alacsonyabb tumorfokozatokhoz kötött pozitív prognosztikai értékkel bírhat.
LRIG2-ről azonban komplexebb képet kaptunk: míg mRNS szinten alacsonyabb kifejeződés jellemző magas malignitás esetén, protein szinten enyhe emelkedés tapasztalható – ez poszt-transzlációs szabályozási mechanizmusokra utalhat.
A másodlagos GBM-ekben mind az LRIG1 mind pedig az LRIG2 proteinexpressziója magasabb volt elsődleges GBM-ekhez képest, ami összhangban van e két altípus eltérő molekuláris profiljával és prognózisával.
Bár korábbi kutatások szerint az LRIG1 növelheti a kemoterápia érzékenységet, jelen vizsgálatunk nem mutatott jelentős változásokat kemoterápiával kezelt betegek esetében – további kutatás szükséges ezen terület tisztázására.
Következtetések
- Az LRIG1 expresszió csökkenése összekapcsolható a glioma malignitásának növekedésével;
- Az LRIG2 szerepe komplexebb lehet, eltérő szabályozási mechanizmusok miatt;
- Az LRIG3 főként alacsonyabb tumorfokozatokhoz kötött pozitív prognosztikai marker;
- Ezek a molekulák potenciális diagnosztikai markerként és terápiás célpontként szolgálhatnak;
- További kutatás szükséges a klinikai alkalmazhatóságuk pontos meghatározására.
Módszertani részletek röviden
- Minta gyűjtés: Humán tumor- és peritumorális agyszövetek neurológiai műtétekből (1998–2017).
- Kvantitatív Western blot: Proteinexpresszió mérésére β-actin normalizálással.
- Kvantitatív PCR: mRNS expressziós szintek meghatározása specifikus primer párokkal.
- Immunfluoreszcencia: Fehérjelokalizáció vizsgálata fluoreszcens antitestekkel.
- Statisztika: Shapiro-Wilk teszt normál eloszlásra; t-próba vagy Mann-Whitney U-teszt páros összehasonlításokra; p<0.05 jelentősnek tekintve.
Köszönetnyilvánítás és finanszírozás
Köszönet Flavia Doraci technikai segítségéért. A tanulmány nem részesült külső finanszírozásban. A szerzők nem jelentenek összeférhetetlenséget.
Irodalomjegyzék kiemelve néhány kulcshivatkozást
- Louis DN et al., Neuro Oncol., 2021 – WHO CNS daganat osztályozás
- Brennan CW et al., Cell., 2013 – Glioblastoma genomika
- Marqués-Torrejón MÁ et al., Nat Commun., 2021 – LRIG1 szerepe idegi őssejtekben
- Johansson M et al., Neuro Oncol., 2013 – Solubilis LRIG1 hatása gliomára
- Mao F et al., J Neurol Sci., 2017 – LRIG fehérjék szerepe gliomában
- Weller M et al., Nat Rev Clin Oncol., 2021 – Glioma kezelési irányelvek
A fenti eredmények hozzájárulnak ahhoz, hogy jobban megértsük az LRIG család tagjainak biológiai szerepét és klinikai potenciálját a gliomák kezelésében.