Bevezetés
Az utóbbi években a fém-oxid nanorészecskék (MO-NPs) kiemelt figyelmet kaptak kivételes tulajdonságaik és széleskörű alkalmazási lehetőségeik miatt. Ezek a nanoméretű anyagok fontos szerepet töltenek be az iparban és az orvostudományban, például töltőanyagként, sterilizálószerként, optikai eszközökben, katalizátorokban, gyógyszerhordozóként és antimikrobiális szerekként.
A ritkaföldfémek közé tartozó cerium (Ce) különleges kémiai viselkedése révén egyedi katalitikus, mágneses, fotokatalitikus és elektronikai tulajdonságokkal rendelkezik. A cerium-oxid nanorészecskék (CeO2NPs), más néven nanoceria, két önregeneráló oxidációs állapotot mutatnak: Ce4+ és Ce3+. Ezek a nanorészecskék nemcsak nagy oxigéntároló kapacitással bírnak, hanem antioxidáns, gyulladáscsökkentő és antitumor aktivitással is rendelkeznek.
Azonban a hagyományos kémiai előállítási módszerek gyakran toxikus vegyszereket használnak, amelyek nem ideálisak biomedicinális alkalmazásokhoz. Ezért egyre nagyobb az igény a környezetbarát, biokompatibilis zöld szintézis iránt, amely során növényi kivonatokat alkalmaznak redukáló és stabilizáló anyagként.
Zöld szintézis quince gyümölcshéj kivonattal
A jelen tanulmányban a CeO2 nanorészecskéket a Cydonia oblonga (quince) gyümölcshéj kivonatának felhasználásával állítottuk elő. Ez a módszer nemcsak környezetbarát, hanem egyúttal fenntartható megközelítést kínál a nanotechnológia területén.
A quince gyümölcs gazdag antioxidánsokban, például kávésav-származékokban és flavonoidokban (quercetin 3-galactoside, kaempferol-3-rutinoside), amelyek hozzájárulnak a nanorészecskék képződéséhez és stabilizálásához. A gyümölcshéj ezen bioaktív komponensei segítik a CeO2NPs előállítását toxikus vegyszerek nélkül.
Cidofovirral való funkcionális módosítás – kettős terápiás platform
A CeO2NPs felületét cidofovirral (CDV), egy anti-DNS vírusellenes szerrel funkcionálisan módosítottuk. Ezáltal egy kettős hatású terápiás rendszert hoztunk létre, amely egyszerre kínál potenciált rákellenes és antivirális kezelésekhez.
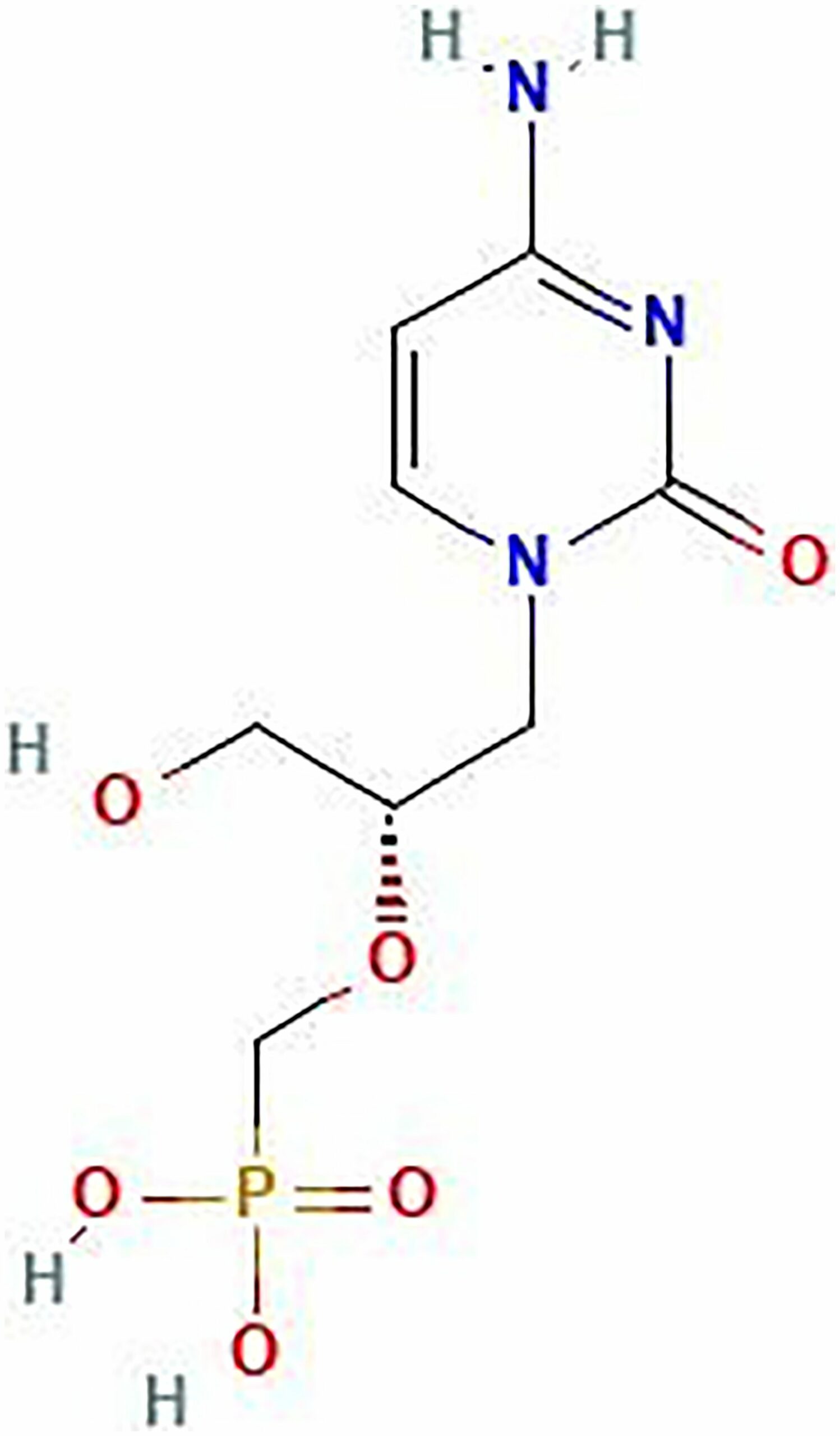
A CDV egy nukleotid analóg antivirális gyógyszer, amely hatékony HPV által okozott daganatok kezelésében is. Korábbi kutatások kimutatták, hogy CDV beépül a DNS-be, károsítva azt és apoptózist indukálva tumoros sejtekben.
Nanorészecskék karakterizációja
UV-Vis spektroszkópia
A zöld szintézisű CeO2NPs UV-Vis spektrumában 250–400 nm között megfigyelhető abszorpciós csúcsok jelentkeztek, melyek az O2p → Ce4+ elektronátmeneteknek felelnek meg. A CDV-CeO2NPs esetében az abszorpciós maximum kb. 21 nm-el hosszabb hullámhosszra tolódott el, ami igazolja a gyógyszer sikeres betöltését.
Zéta-potenciál és DLS méretanalízis
A CeO2NPs negatív felületi töltése -15.6 mV volt, míg a CDV-CeO2NPs esetében ez -33.5 mV-ra nőtt, ami stabil kolloid rendszert jelez. A dinamikus fényeloszlás (DLS) mérések szerint a részecskeméret átlagosan 128.4 nm volt CeO2NPs esetén, míg CDV betöltés után 261.2 nm-re nőtt, ami megerősíti a gyógyszer bevonat jelenlétét.
FE-SEM és EDX elemzés
A FE-SEM képek flake-szerű aggregátumokat mutattak CeO2NPs esetén; CDV betöltés után a morfológia megváltozott, apró szemcsék jelentek meg a felületen. Az EDX elemzés erős Ce és O jeleket mutatott, továbbá CDV jelenlétére utaló foszfor (P) csúcsot is kimutattunk.
TEM képek
A TEM vizsgálatok feltárták a maghéj szerkezetet: a sötét belső mag CeO2NPs-t jelölte, míg az ezüstös külső réteg a CDV-t reprezentálta. Az egyedi részecskék átmérője kb. 15 nm volt; azonban jelentős aggregáció figyelhető meg vízi közegben.
FT-IR spektroszkópia
Az FT-IR spektrumok megerősítették mind a CeO2NPs-re jellemző funkciós csoportokat (pl. Ce-O kötés), mind pedig a CDV specifikus csoportjait (pl. P=O és P-O kötés). A CDV-CeO2NPs spektrumában mindkét komponens jellemző csúcsai megjelentek.
In vitro citotoxicitás – MCF-7 emlőrák sejtvonalon
Az MTT vizsgálatok során megállapítottuk, hogy mind a CDV, mind a CeO2NPs önmagukban mérsékelten gátolják az MCF-7 sejtek növekedését. Ugyanakkor a CDV-CeO2NPs komplex jelentősen fokozta az antitumor hatást: 64 μg/mL koncentrációnál 97% feletti sejtpusztulást értünk el.
- IC50 értékek:
- CDV: 21.83 μg/mL
- CeO2NPs: 40.11 μg/mL
- CDV-CeO2NPs: 4.46 μg/mL – mintegy 5-ször hatékonyabb!
Eredményeink összevethetők más nanohordozós rendszerekkel is; például γ-Fe2O3@SiO2-CDV komplexeknél jóval alacsonyabb IC50 értéket értünk el.
Nukleinsavakkal való kölcsönhatások vizsgálata
UV-Vis spektroszkópia – DNS/RNS komplexképződés
A CDV-CeO2NPs hozzáadása DNS/RNS oldathoz hypokróm effektust váltott ki az abszorpciós spektrumban, ami stabil komplex kialakulását jelzi. Az izosbécikus pont jelenléte további bizonyíték arra, hogy valódi kötődés jött létre.
Kötési állandók meghatározása
- Kötési állandók (Kb):
- DNS esetén: 3.63 × 103 M-1
- RNS esetén: 1.26 × 103 M-1
Fluoreszcencia vizsgálatok – kötési mód feltárása
A groove binderek (Hoechst 33258) és interkalátor (Acridine Orange) fluoreszcencia displacement kísérletei alapján:
- DNS esetén: A CDV-CeO2NPs részben interkalálódik a DNS helixbe és részben kötődik annak groove-jába.
- RNS esetén: Gyengébb groove kötést mutatott; főként verseng az AO-val ugyanazon kötődési helyért.
Kvantitatív adatok – Stern–Volmer analízis és termodinamikai paraméterek
A fluoreszcencia elnyomási vizsgálatok Stern–Volmer állandói hőmérséklettől függően változtak:
- DNS rendszernél: Dinamikus quenching dominált (Ksv nőtt hőmérséklettel).
- RNS rendszernél: Statikus quenching volt jellemző (Ksv csökkent hőmérséklettel).
A termodinamikai paraméterek pozitív entalpia- és entrópiaértékei hidrofób kölcsönhatások jelenlétére utalnak a nukleinsav-CDV-CeO2NPs komplexek kialakulásában.
Módszertan rövid összefoglalása
- Cerium-nitrát hexahidrát sót kevertünk quince héj kivonattal 80°C-on 20 órán át;
- Kicsapódott fehéres anyagot kalcináltuk 400°C-on;
- A kapott CeO2 nanoporcot vízben diszpergáltuk ultrahangos kezeléssel;
- Egyenlő térfogatban kevertük össze cidofovir oldattal 24 órán át;
- Centrifugálással elkülönítettük a CDV-CeO2 nanokomplexet;
A sejtvonalas vizsgálatokhoz MCF-7 emlőrák sejteket tenyésztettünk DMEM táptalajon megfelelő antibiotikumokkal és FBS-sel ellátva.
Nukleinsav-kölcsönhatások vizsgálatához tiszta kalf thymus DNS-t és élesztő RNS-t használtunk Tris-HCl pufferoldatban.
Következtetések
A quince gyümölcshéj kivonatával végzett zöld szintézis környezetbarát módot kínál cerium-oxid nanorészecskék előállítására. A cidofovirral való funkcionális módosítás révén létrejött CDV-CeO2NPs kettős terápiás potenciállal bír mind rákellenes, mind antivirális alkalmazások terén.
A részletes karakterizáció megerősítette e nanokomplexek stabilitását és sikeres gyógyszerbetöltését. In vitro vizsgálatok igazolták fokozott citotoxicitásukat MCF-7 sejtek ellen összevetve önmagában alkalmazott CDV vagy CeO2 nanopartikulumokkal.
Nukleinsavakkal való kölcsönhatásaik erős kötődést mutattak UV-Vis és fluoreszcencia spektroszkópiai módszerekkel alátámasztva, ami ígéretes alapot nyújt célzott gyógyszeradagolási rendszerek fejlesztésére.
További in vivo vizsgálatokra van szükség az alkalmazhatóság klinikai megerősítésére és molekuláris mechanizmusok mélyebb feltárására.
Köszönetnyilvánítás
Szerzőink köszönetet mondanak az iráni Kermanshah-i Razi Egyetemnek laboratóriumi infrastruktúrájukért és technikai támogatásukért.
Szerzői hozzájárulások
- Nahid Shahabadi: elemzés tervezése;
- Saba Zendehcheshm: adatgyűjtés;
- Fatemeh Khademi & Mohammad Mahdavi: adatközlés;
- Minden szerző hozzájárult a kézirathoz.
Irodalomjegyzék – válogatás fontosabb forrásokból
- Muthuvel et al., Nanotechnol Environ Eng., 2020 – fémoxid nanopartikulumok szintézise;
- XU & Qu., NPG Asia Mater., 2014 – nanoceria biológiai alkalmazások;
- Mertens et al., Oncotarget., 2016 – cidofovir DNS károsító hatása;
- Hadaczek et al., Clin Cancer Res., 2013 – glioblastoma elleni antitumor aktivitás;
- Kumar & Poornachandra., Colloids Surf B Biointerfaces., 2015 – biodirected nanopartikulum készítés;
- Babashpour-Asl & Piryaei., Int J Hortic Sci Technol., 2021 – quince antioxidáns összetevők;
- Dutta et al., J Environ Chem Eng., 2020 – zöld szintézisű ezüst nanopartikulumok;
- Tarnuzzer et al., Nano Lett., 2005 – nanoceria sugárzás elleni védelme;
- Kausar et al., Int J Immunopathol Pharmacol., 2021 – antivirális gyógyszerek mechanizmusa;
- Mertens et al., Oncotarget., 2016 – HPV elleni cidofovir hatásmechanizmus;
- Turel & Kljun., Curr Top Med Chem., 2011 – fémion-DNS kölcsönhatások relevanciája anticancer kutatásban;
- Bharathi et al., Int J Biol Macromol., 2019 – chitosan bevonatú ZnO nanokompozit antibakteriális hatása;
- Dhall & Self., Antioxidants (Basel)., 2018 – cerium oxid nanopartikulumok biomedicinális alkalmazása;
- Kannan & Sundrarajan., Int J Nanosci., 2014 – zöld cerium oxid nanopartikulum szintézis;
- Babashpour-Asl & Piryaei., Int J Hortic Sci Technol., 2021 – quince antioxidáns profilja;
- Mertens et al., Oncotarget., 2016; Hadaczek et al., Clin Cancer Res., 2013 – cidofovir antitumor hatása különböző daganatokban.